|
【中国・医薬品】 2012/4/4
中国薬価について2012年最新情報
全人代は14日、「医療をもっと国民の手が届くものにすること、国家負担の健康保険を拡大すること」を宣言し閉幕した。
この方針を実現するための施策の一つとして、安徽省で試験導入された入札制度が実施される見通しで、製薬各社には国家契約を勝ち取るために価格面や品質面で競争することが求められる。
従来は高齢者の世話は子供たちが担ったが、都市化や一人っ子政策の影響で家族による介護は縮小して、国家の負担は増している。
中国の医療制度改革を監督する立場にある国家発展改革委員会の孫志剛副主任によれば、政府は入札という新たな調達手段を拡大することで、必須薬品リストに掲載された薬品の価格を少なくとも30%引き下げようとしている。一方「政府は必須薬品リストの掲載薬品数を引き続き増やすとともに、それを適用する医療施設の範囲を拡大しようとしている。薬品の販売量が増加するため、製薬企業にとってこの動きは長期的にはプラスになる」と指摘した。
中国内製薬大手の上海復星医薬を傘下に置く復星国際の会長で共同創設者の郭広昌氏は3月上旬、北京で記者会見を行い、「この医療制度改革は、基本的に入札で価格を競わせるというものだが、私が思うに、これは製薬業界に対して無責任なやり方だ。価格にばかり注目せず、品質保証を最優先すべきである。さもなければ中国の製薬企業にとって極めて不公平なものになるだろう」と厳しく指摘した。
ファイザーやメルクなど国際的製薬企業の利益を代表する業界団体の薬品研究開発業界委員会(RDPAC)も「安徽省モデル」の入札制度の拡大に反対しロビー活動を展開している。一方、英製薬最大手グラクソスミスクラインのウィッティ最高経営責任者(CEO)はインタビューに応じ、中国政府から不利な扱いを受けたことはないとしている。同CEOは「中国には政府が対処すべき緊張関係が生じているが、われわれは公平な扱いを受けていると感じている。われわれが求めているのは公平な舞台であり、中国にはそれがあると思う」との見方を示した。
政府は「利益幅が大きく縮小しているとはいえ、各社は今も採算性を維持している。政府内には、そのことだけでも今年のさらなる薬価引き下げの十分な理由になるとの意見がある」と述べた。
また、中国政府は薬価引き下げの範囲を拡大してがん治療や心臓病の薬なども対象に含めることを視野に入れており、影響を受ける製薬企業がさらに増える可能性もあるという。しかし後発薬でも高品質になったもの、GMPなど製造による品質改善にも力を入れており、薬価を調整すると言っている。いずれにせよ今後も医療業界は政府の政策のなかでスケープゴードになると言うのが大方の見方である。
弊社で調査したところ、今回実施された薬価の見直しでは必須医薬品リストで17%程度、それ以外は3%程度の下げ幅にとどまっている。
必須医薬品リストについて
衛生部は2日、2012年の重点施策を示す「衛生工作要点」を公表した。その中で、国民が必須医薬品を確実に入手できるよう、国家基本薬品制度の実施範囲を広げる方針を示した。農村での制度実施を推進し、各地方の非政府系医療機関の制度参加を後押しする。また、「2012年版国家必須医薬品リスト」を完成した上で、各地方がリストに含まれない医薬を増補することを認める。さらに全ての医療機関が必須医薬品を優先的に使用することを推奨する。
国家基本薬品制度は2009年に導入された。必須医薬品は基本的な医療に必要とされる医薬を指し、国民が合理的な価格で十分な量を入手できるよう、政府系の医療機関へ配備される。化学・生物医薬のほか、漢方薬も含まれる。滋養強壮目的の薬品は対象外。
必須医薬品の選定は衛生部が中心となって作成する。最初の必須医薬品リストは2009年に公表された。リストは3年に1度、見直されることになっており、今年は更新の年に当たる。各省は同リストと政府が設定した医薬品価格基準に従い、医薬品の製造業者と販売・配送会社を公開入札で決定する。
(2012/4/3)
製薬企業のビジネスチャンス
新版基本薬物リスト
衛生部は4月に発表した重点施策の上半期の結果を公表したそれによると中国での医薬品製造業の1~7月の売上総額は、前年同期比で19.08%増加し、1~6月の増加率0.01%のプラスとなった。利益総額に於いては、対前年同期比で17.76%増加し、1~6月の増加率に比較し0.39%のアップとなり、累計粗利益率は29.32%、期間費用率は18.44%と、1~6月と比較し、それぞれ0.01ポイントダウン、0.12ポイントアップであった。
9月におこなわれた抗腫瘍薬類等の最高小売価格調整と共に、発展改革委員会の2年間を跨いだ化学製剤に対する最高小売価格調整は終了し当面の間、政府の“薬価”引き下げの危険性は無くなった。
この第4四半期には、2012年版基本薬物リストが発表され、新リストの掲載品目は最初の307品目から700品目までに拡充され、新規掲載の約300品目が追加され、特に単独品目を持つ製薬企業には大きな投資のチャンスとなる。基本的に“下半期の業界の動向は依然として安定を保ちながら、やや上昇することが伺え、今年の年間の利益額の伸びは18~20%の間である”と予測され。政策面から見て投資の良い機会となりうる。
(2012/10/19)
国務院から電子管理
中国は今年末までに、すべての基本医薬307種を電子モニターネットワークで監督管理することを計画している。これは中国の製薬会社の7割にあたる3500社余りをカバーするもの。このほど全国食品医薬品監督管理業務座談会で明らかにされた。 この医薬電子管理ネットワークは統一的に全国をカバーする監督管理システムで、医薬品の生産から出荷、流通、輸送、貯蔵、医療機関への配送までの全過程を監視する。医薬品の生産、販売、在庫、流通状況のリアルタイムの照会が可能で、問題が見つかれば、迅速なトレーサビリティ(履歴追跡)と回収ができる 国務院の医薬品医療衛生体制改革に関する文書は、基本医薬の電子管理を基本医薬制度整備の重要な内容としている。関係の規定によると、基本医薬生産の落札企業は来年3月31日までに電子管理ネットに入らなければならない。基本医薬の取り扱い企業は管理コードによる情報の収集と送信が義務付けられている。
国家食品医薬品監督管理局は今年、中央財政に対して基本医薬生産企業にデジタル証明書を配布し、訓練を行うための資金を申請した。
中国の医薬電子管理は「段階に分け、着実に推進する」原則に従って実施する。
これまでに麻酔薬、一類、二類向精神薬、血液製剤、ワクチン、漢方注射薬の電子管理を実現した。そのうち麻酔薬と一類向精神薬の電子管理に関係する生産企業は18社、卸売企業は560社、二類向精神薬、血液製剤、ワクチン、漢方注射薬の電子管理に関係する生産企業は568社、卸売企業は約1・3万社に上っている。
基本医薬の電子管理のほか、抜き取り検査も食品医薬品監督管理官庁の今年の業務の重点の一つで、検査結果を迅速に発表し、不合格の製品および生産、取り扱い、使用機関の処分を行う。輸入薬品に電子監督管理を実施する通知
(国家食品薬品監督1月29日付けで、国食薬監安号通知にて、輸入薬品に対する電子監督管理の実施に関する通知を発表した。これは、『2011-2015年薬品電子監督管理作業計画の配布に関する通知』(国食薬監弁>201264号)と『年度薬品電子監督管理作業に関する通知』(食薬監弁〔2012〕)85号)を徹底させるために、発表されたものである。同通知では、海外の製薬企業は中国に輸入する薬品の電子監督管理の実施に最終責任を負いが規定している薬品の品種と期限に従い薬品の電子監督管理を行うことを明らかにした。
また海外の製薬企業は中国国内での薬品生産企業、薬品卸売企業、中国支社或いは事務所のいずれを指定し、薬品電子監督管理の代理者にすると規定されている。其の代理者は中国薬品監督管理部門や関連機構と連絡し、企業の薬品電子監督管理の実施に助力し、海外工場の電子監督管理コードの申請やデータのアップロード及び関連薬品のリコールなど具体的な作業を協力する。
海外製薬企業はSFDA『薬品電子監督管理作業の指導意見』と『薬品電子監督管理技術の指導意見』の要求に従い、輸入薬品の電子監督管理の実施を展開しなければならない。また、海外企業は薬品輸入登録を申請する時、『薬品輸入管理弁法』第十三条第一項七番目の登録資料以外、コード付薬品の各ロット番号と各級包装の実物のサンプルまたは写真を追加することも規定されている日まで電子監督管理を実施する輸入薬品について、海外製薬企業の代理者が日まで報告を提出し、関連企業を中国薬品電子監督管理ネットに登録しなければならない。
*会員になられますとバーコードの申請手順から製作までの資料(上記)が入手できます。
医薬品の電子管理は全体の3分の1
中国国家食品薬品監督管理局は、現在中国の3分の1の医薬品がすでに電子管理を実施していることを明らかにした。
医薬品の電子管理はコンピューターネットワークなどの通信技術を利用し、医薬品にそれぞれ異なる電子コードをつけ、医薬品の「身分証明書」のような電子コードを通じ、生産・流通の状況をフォローし医薬品の安全を確保する。消費者は医薬品を購入した後、電話、携帯メール、インターネットなどの方法でパッケージに印刷された電子コードをチェックし医薬品の関連情報を参考に、薬の真偽を判断できる。偽薬が氾濫している中国では必須のシステムで、2015年までに医薬品の全品種の電子管理を実現させる。
(1012/7/5)
輸入医薬品電子監督管理の実施に関する通知 2013年1月29日
2013年1月29日、国家食品医薬品監督管理局は、同局による「2011-2015年医薬品電子監督管理企画に関する通知」(国食監弁〔2012〕64号)と「2012年度医薬品電子監督管理の円滑な実施に関する通知」(食薬監弁〔2012〕85号)をしっかりと実施するために、「輸入医薬品電子監督管理の実施に関する通知」を発表した。
輸入医薬品電子監督管理の実施に関する事項を以下のとおり通知した。実施日時に関しては医薬品メーカーが2012年版「国家基本医薬品目録」に収録されている医薬品を生産する場合、基本医薬品入札と調達に参加するかどうかにかかわらず、いずれの場合にも規定に従って電子監督管理を実施しなければならないと要求している。
国産医薬品と、国内で分割して包装する輸入医薬品は2013年11月末までに、輸入医薬品は2014年3月末までに、電子監督管理を実施しなければならないという。
また、同公告では、関係メーカーと輸入医薬品の海外メーカーが、元国家食品医薬品監督管理局による「輸入医薬品電子監督管理の実施に関する通知」(国食薬監安〔2013〕23号)、「医薬品電子監督管理業務指導意見の発表に関する通知」(国食薬監弁〔2010〕283号)と「2012年度医薬品電子監督管理業務の円滑実施に関する通知」(食薬監弁[2012]85号)の要求に従い、積極的に関係業務を展開し、国家基本医薬品電子監理計画どおりの実施を確保するよう求められている。
①、海外医薬品メーカー(「輸出医薬品登録証」または「医薬製品登録証」の「会社名」項目に記入されている会社)は我国に輸出した医薬品の電子監督管理の実施に対し全責任を負い、国家食品医薬品監督管理局の規定した品目と期限によって医薬品の電子監督管理を実施し、我国国内における医薬品メーカー、医薬品卸売企業、子会社または事務所のうちから一社を選び、医薬品電子監督管理代理機構(以下は電子監督管理代理機構と略称する)に指定しなければならない。
②、海外医薬品メーカーはその電子監督管理代理機構を我国の医薬品監督管理機関と関係機関との固定連絡先とし、授権と委託を行わなければならない。我国国内で電子監督管理の関連事項の実施に協力する必要がある。また、その海外工場が電子監督管理コードの申請、データのアップロード、商品のリコールを行う際に、協力する必要がある。
③、電子監督管理代理機構はその情報と受託事項を添付1の書式と要求に従い、国家食品医薬品監督管理局行政受理サービスセンターに報告しなければならない。上述の情報、受託事項が変更されるか、委託・受託関係が終結する場合、5営業日以内に報告しなければならない。
④、海外医薬品メーカー及びその「輸入医薬品登録証」または「医薬製品登録証」に明記されているメーカー(または包装工場)と電子監督管理代理機構が中国医薬品電子監督管理ネットに加入する手続きについては、その電子監督管理代理機構は該当外国医薬品メーカーからの委託を受けた後、一括して手続きを行い、デジタル証書を取得することができる。初回加入の場合、「輸入医薬品関係企業ネット加入登録表」を「輸入医薬品電子監督管理代理機構報告表」と一緒に、国家食品医薬品監督管理局行政受理サービスセンターに提出しなければならない。
⑤、海外医薬品メーカーは国家食品医薬品監督管理局による「医薬品電子監督管理作業に対する指導意見」と「医薬品電子監督管理技術に関する指導意見」に従い、輸入医薬品の電子監督管理を実施しなければならない。電子監督管理コード付け作業(各レベルの医薬品包装の区別と関係をつける作業も含む)は輸入医薬品登録証に明記されているメーカーと包装工場内で実施されなければならない。中国国内で小分け包装の批准を取得した品目の場合、批准された小分け包装メーカー内で電子監督管理コード付け作業を行うことができる他の場所で、梱包を済ませた大きい包装製品を解体させ、電子監督管理コード付けを行なってはいけない。インターネット等の原因で、海外で中国医薬品電子監督管理ネットにアクセスするのが困難を生じた場合、電子監督管理コードの申請、電子監督管理コード、関連データ及び医薬品入庫、出庫データのアップロード、税関での登録と検査を、電子監督管理代理機構に依頼することが可能である。
⑥、輸入者は医薬品輸入の登録届出を行う際に、「医薬品輸入管理方法」の第十三条第一款第七項の規定した登録届け出資料の中に監督管理コード付け済みの医薬品の各ロッド番号、各レベルの包
装のサンプル、或いはその写真を添付し、当該医薬品に電子監督管理コードを貼り付けたこと、或
いは印刷したことを証明しなければならない。提出した写真は一つの画面上で上述の情報が全部はっきりと写っているものでなければならない。
⑦、2013年12月31日以前に電子監督管理を実施する輸入医薬品の場合、その電子監督管理代理機構は2013年2月28日までに報告書を提出し、そして、その関連機構を中国医薬品電子監督管理ネットに加入させる必要がある。加入済みの企業は「輸入医薬品企業ネット加入用登録表」の要求に従い、必須の情報を補足しなければならない。
2013年1月1日以降、増補した国または地域レベルの基本医薬品の場合、その海外メーカーがまだ電子監督管理代理機構を指定していないなら、速やかに指定し、本通知の要求に従い、代理機構の情報を報告し、ネット加入の手続きをとらなければならない。また、新目録発表後の12カ月以内に当該輸入医薬品の電子監督管理コードを取得し、税関での確認と抹消などを実施しなければならない。
⑧、省レベルの医薬品監督管理機関は国家食品医薬品監督管理局ウェブサイトで公開された輸入医薬品電子監督管理代理機構の名簿と輸入医薬品のデータによって、当該代理機構及び代理を依頼した海外医薬品メーカーが登録したすべての輸入医薬品を電子監督管理の対象とし、電子監督管理代理機構に対しトレーリング、指導を行い、代理を依頼した海外医薬品メーカーが規定された期限や品目、要求に従い、電子監督管理を実施するよう促さなければならない。また規定に違反し、包装を解体させ、箱ごとに電子監督管理コード付けを行なった医薬品が存在する場合、直ちに改正するよう求めなければならない。
⑨、港湾レベルの医薬品監督管理局は国家食品医薬品監督管理局が規定した品目別電子監督管理の実施期限に従い、輸入医薬品の登録と審査を行う際に、電子監督管理品目に対して生産日時による電子監督管理コードの取得状況をチェックしなければならない。要求に従わず電子監督管理コードを取得していない医薬品を発見した場合、輸入の登録を拒否し、その電子監督管理代理機構の所在地における省レベルの医薬品監督管理機関に通報しなければならない。
⑩、港湾レベルの医薬品監督管理局は2013年12月31日以前に電子監督管理を実施された品目に対し、2014年1月1日から検査を始める。それ以前に生産された医薬製品の場合、規定に従って電子監督管理コード付けしてから、輸入の登録を行う可能である。それ以降に生産され、電子監督管理コードを取得していない医薬製品の場合、期限経過後に登録申請を受理されなくなるため、遅くとも2014年4月30日までに輸入の登録を行わなければならない。
各省レベルの医薬品監督管理機関と港湾レベルの医薬品監督管理局は特別な注意を払い、職責をしっかりと果たし、制度をきちんと守り、本通知の要求に従って各作業を円滑に実施しなければならない。関係作業で問題が発生する場合、国家食品医薬品監督管理局医薬品安全監管司に速やかに報告しなければならない。
pdf.
(2013年2月6日)
国家食品医薬品監督管理局医薬品登録司は許可管理を実施する
医薬品添加剤品目(第一陣)について意見募集を開始しました
国家食品医薬品監督管理局の発布した「医薬品添加剤監督管理強化に関する規定」の中の医薬品添加剤に対し、分類管理を実施する規定を実行するため、国家食品医薬品監督管理局医薬品登録司は専門家を組織し、医薬品添加剤の新定義及び第一陣の許可管理を実施する医薬品添加剤品目リスト(選定されなかった添加剤に対し、届け出管理を実施すること)を制定した。2013年1月23日から、広く公開的に意見を募集し始めた。
応募の締切は2013年2月15日
許可管理を実施する予定の医薬品添加剤リスト(第一陣)
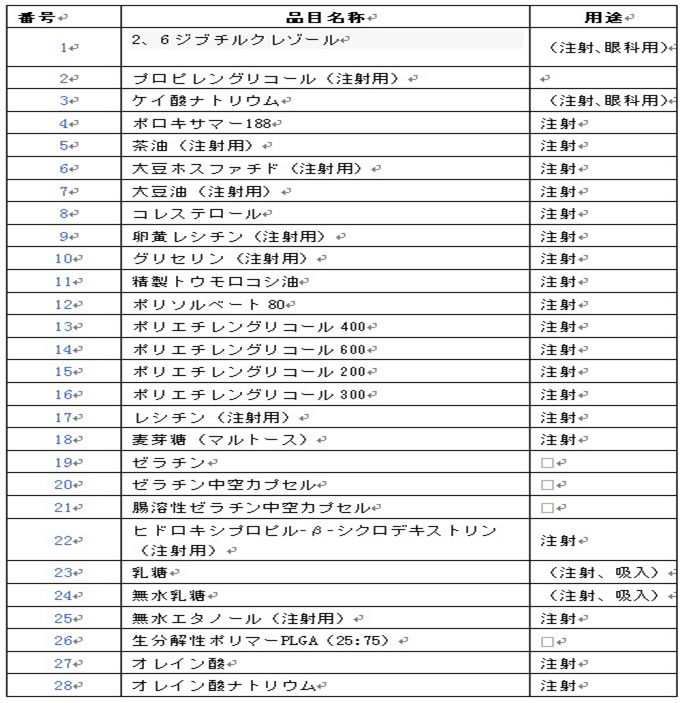
出所:SFDA 2013-01-29
Home
|

